上海泽威信息科技有限公司
地址:上海市松江区东宝路19号东宝大厦602室
电话:86 21-3126 1348
电话:86 21-5771 2250
传真:86 21-5771 2250
电邮:cvtest@126.com
QQ:870335905
QQ:578020381
Wechat:wx578020381

您的位置:网站首页 > 医疗器械MDSAP审核
一、什么是MDSAP?
MDSAP是Medical Device Single Audit Program(医疗器械一体化审核程序)的缩写,是由IMDRF(International Medical Device Regulators Forum国际医疗器械监管者论坛)发起的一体化审核程序;IMDRF是由GHTF(The Global Harmonization Task Force全球协调工作组)演化而来;IMDRF/GHTF的主要任务,是致力于全球医疗器械法规和标准的协调一致;ISO13485的出版、发布并实施,是IMDRF/GHTF的工作成果之一,是对全球医疗器械质量管理的重大贡献。
二、谁参与并认可MDSAP?
参与并认可的机构包括:
1.Therapeutic Goods Administration of Australia (TGA)
2.Brazil’s Agência Nacional de Vigilância Sanitária (ANVISA)
3.Health Canada (HC) :完全代替以往的CMDCAS认证
4.Japan’s Ministry of Health, Labour and Welfare (MHLW), and the Japanese Pharmaceuticals and
Medical Devices Agency (PMDA)
5.U.S.Food & Drug Administration (FDA):代替常规检查
三、谁需要满足MDSAP的要求?
医疗器械拟销往Canada的企业
主动要求满足MDSAP的企业
MDSAP的申请认证范围,必须包括医疗器械计划销售的所有认可国
四、推行MDSAP的意义?
1.促进不同国家监管模式协调一致;
2.降低各参与国主管当局的监管成本;
3.便于企业整合不同国家的质量体系要求和法规要求;
4.降低被监管企业的管理成本;
五、MDSAP的审核内容?
ISO 13485:2016的内容
MDSAP认可国医疗器械上市前要求
MDSAP认可国医疗器械上市后要求,包括主管当局的市场监督要求
MDSAP认可国对质量体系的要求(特别是ISO 13485:2016没有包含的要求)
MDSAP认可国其他专门法规的要求(如:美国公共健康服务法的要求)
六、MDSAP如何工作?
三年审核周期
1.初始审核 (阶段1和阶段 2)
2.监督审核 (第1年和第2年)
3.重新审核 (换证)
七、MDSAP审核模块
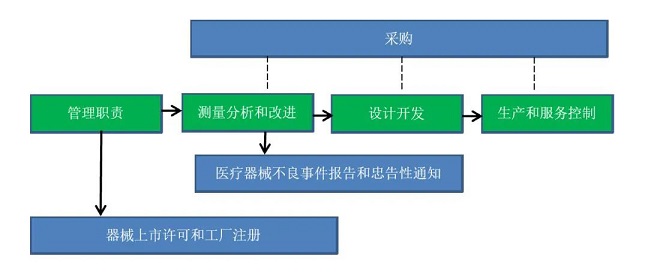
|
过程类别 |
过程 名称 |
子任务 |
||
|
数量 |
名称 |
|||
|
主要过程 |
第一过程 管理职责 |
11个 |
1.管理体系策划 2.管理者代表 3.质量方针和目标 4.组织机构、职责、权限、资源 5.外包过程管理 6.人员资质、培训
|
7.风险管理的策划和符合 8.文件控制 9.管理评审 10.基于市场准入的发货 11.最高管理层的质量承诺 |
|
支持过程 |
第二过程 器械上市许可和工厂注册 |
3个 |
1.医疗器械产品和工厂注册的递交 2.市场准入或批准的证据 3.质量体系有关变更的上报 |
|
|
主要过程 |
第三过程 测量分析和改进 |
16个 |
1.测量、分析和改进过程程序 2.质量数据来源 3.不合格品调查 4.潜在不和格的调查 5.纠正、纠正措施和预防措施 6.评估设计变更导致的纠正和预防措施 7.评估过程变更导致的纠正和预防措施 8.不合格品的识别和控制 |
9.产品放行后的不合格品控制措施 10.内审 11.管理评审的信息输入 12.生产后信息包括投诉的评估 13.投诉方面与外部相关方的联系 14.不良事件的通知 15.忠告性通知 16.管理层承诺 |
|
支持过程 |
第四过程 医疗器械不良事件报告和忠告性通知 |
2个 |
1.不良事件上报 2.召回要求 |
|
|
主要过程 |
第五过程 设计开发 |
17个 |
1.研发流程识别与建立,技术文件 2.选择完成的研发项目 3.设计开发策划 4.执行设计开发过程 5.设计开发输入 6.设计开发输入完整、一致、不冲突 7. 设计开发输出和设计验证 8.设计开发风险管理 |
9.对于风险控制措施的验证和确认10.设计开发确认 11.临床评估 12.软件规范 13.设计开发变更 14.设计评审 15.开发变更对已制造产品的影响评估 16.设计转移 17.管理层承诺 |
|
主要过程 |
第六过程 生产和服务控制 |
29个 |
1.生产和服务过程策划 2.生产和服务过程的选择 3.被选择生产和服务过程的执行和控制 4.产品清洁 5.设施设备 6.工作环境 7.识别需要确认的过程 8.过程确认 9.灭菌确认过程 10.产品符合性的监视和测量 11.控制、运行和监视过程,风险管理 12.人员能力 13.设备的监视和测量 14.不合格器械的监视测量影响分析 15.生产和服务过程中软件确认 |
16.器械主文档(DMR) 17.生产记录,器械合规性(DHR) 18.植入物、生命支持设备或维持设备的追溯性 19.产品状态的识别 20.客户财产 21. 产品接受准则 22. 不合格品的标识、控制和处置 23. 不合格品的返工 24. 产品防护 25. 客户要求的评审,销售记录 26. 安装活动 27. 服务活动 28. 运输、安装和服务过程中的风险控制 29. 管理层承诺 |
|
支持过程 |
第七过程 采购 |
12个 |
1.采购和外发过程的策划 2.采购供应商的抽样 3.采购及外发过程程序的建立 4.对供方和采购产品的控制程度,供应商选择、评价和再评价的准则 5.对于满足采购规范的供方选择评估 6.供方的业绩监控 |
7.供方的再评估 8.采购要求和供方协议 9.文件化的采购要求和追溯要求 10.采购产品的验证 11.采购资料输入的测量分析和改进 12.最高管理者对采购过程的承诺 |
八、MDSAP审核剪影
