上海泽威信息科技有限公司
地址:上海市松江区东宝路19号东宝大厦602室
电话:86 21-3126 1348
电话:86 21-5771 2250
传真:86 21-5771 2250
电邮:cvtest@126.com
QQ:870335905
QQ:578020381
Wechat:wx578020381

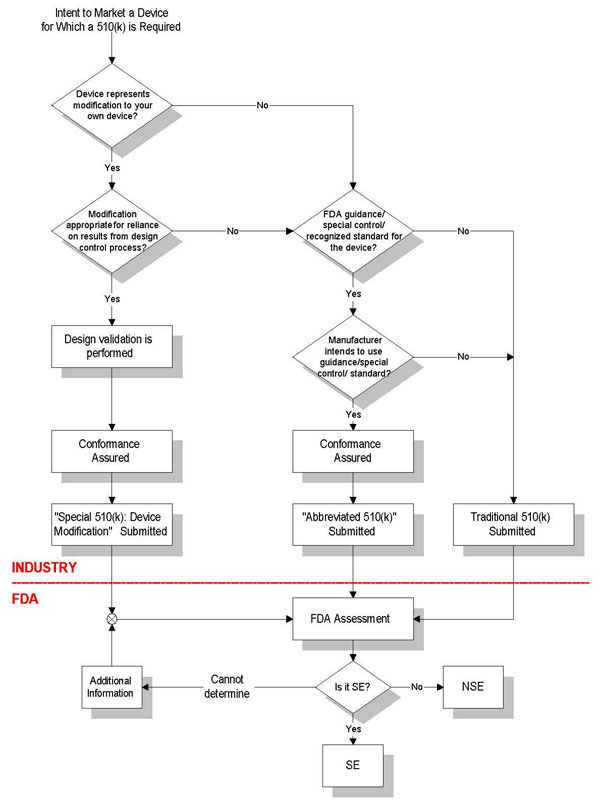
FDA 510(k)申请方式
传统审核-适用于新器械,申请时需递交适用的性能报告。
特殊审核-适用于依照设计控制程序作了较小改动的器械。
简化审核-由制造商提交,制造商必须确保并声明其产品符合现有FDA认可的标准。
不同510(k)申请要求
传统510(k)
包含21 CFR中规定的510(k)的所有要素,在90天内审核。
特殊510(k)
1)申请人对其合法销售器械进行了重大改动;
2)申请人认为需要进行新的510(k)申请;
3)这些改动不影响器械的预期用途或基本科学技术;
4)申请人按照21CFR中设计控制的要求对改动进行评估;
5)申请人递交510(k)申请的同时,也递交符合设计控制原则的声明;
6)在30天内审核。
简略510(k)
1)申请人递交新器械的510(k)申请;
2)器械适用特殊控制规定:指导性文件或公认标准;
3)申请人遵从指导性文件和/或公认标准;
4)包含21CFR中规定的510(k)的所有要素;
5)递交510(k)申请时,同时递交遵从指导性文件或公认标准的总结信息;
6)在90天内审核。
FDA510(k)申请流程图
上海泽威专业提供美国医疗器械FDA注册,FDA认证,FDA 510k指导和编写,美国代理人服务。